I prodotti farmaceutici sono diventati brevettabili in Italia nel 1978 per una sentenza della Corte Costituzionale, seguita dalla ratifica della Convenzione di Monaco, che istituiva il Brevetto Europeo e dall'emanazione del D.P.R. n. 338/1979, che adeguava la normativa nazionale.
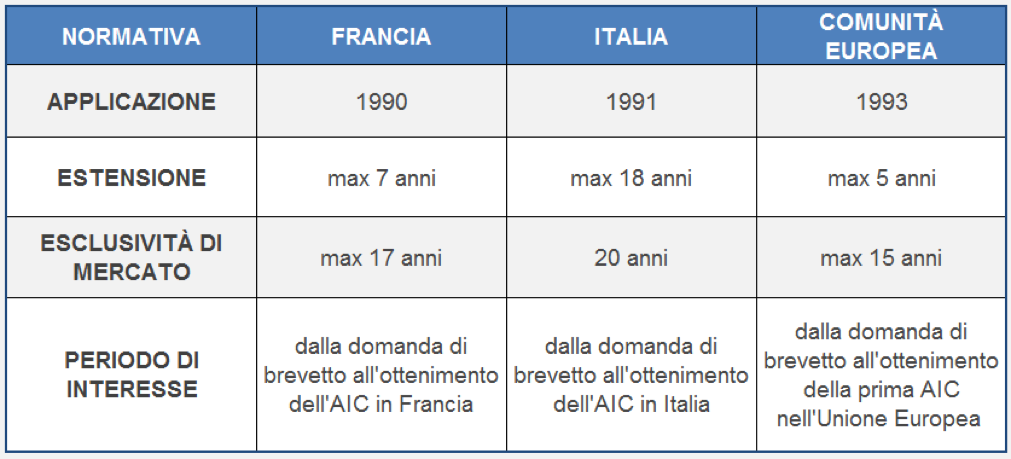
Il brevetto di un medicinale garantisce, come per tutte le altre invenzioni, la facoltà esclusiva di sfruttamento per venti anni dalla data in cui ne è stata depositata la domanda. Dalla data di presentazione della domanda di brevetto a quella di rilascio della prima autorizzazione all'immissione in commercio di un medicinale, possono però trascorrere anche numerosi anni che andrebbero a ridurre drasticamente la possibilità di sfruttamento esclusivo dell'invenzione.
Il Certificato Complementare di Protezione
Per questo motivo la Legge n. 349 del 19 ottobre 1991 ha istituito il Certificato Complementare di Protezione (CCP) che consentiva l'estensione del periodo brevettuale, stabilito in 20 anni per i prodotti medicinali, fino ad un massimo di 18 anni oltre la scadenza naturale del brevetto: è stata così introdotta una modalità per realizzare il recupero dei tempi necessari per le sperimentazioni e l'ottenimento dell’AIC.
In questo modo però, in Italia, tenendo conto dei venti anni di protezione brevettale, la copertura totale garantita ha potuto estendersi fino ad un massimo di 38 anni dalla data di deposito della domanda di brevetto stesso.
Le suddette disposizioni a carattere nazionale sono state poi di fatto abrogate dal Regolamento CEE n. 1768 del 1992, istitutivo del Certificato Protettivo Supplementare (Supplemetary Protection Certificate - SPC), che oltre a presentare le medesime finalità del CCP, ha come scopo principale l'armonizzazione delle normative di ciascuno Stato membro in questa materia.
La differenza tra le due normative risiede nella durata massima dell’estensione concessa alla fine della durata legale del brevetto che, per il CCP non può essere superiore a 18 anni, mentre per il SPC non può superare i 5 anni.
A oggi il Ministero dello Sviluppo Economico - Ufficio Italiano Brevetti e Marchi ha pubblicato in virtù dell’articolo 9 della Legge, comma 2-bis, del decreto-legge 31 dicembre 2007, n. 248 la lista dei certificati complementari di protezione (CCP) concessi ai sensi della Legge n.349 del 19 ottobre 1991 e ai sensi del Regolamento n.1768/92/CEE del 18 giugno 1992, con data di scadenza a partire dal 29 febbraio 2008, data di entrata in vigore della Legge n. 31 del 28 febbraio 2008.
La Legge n. 112 del 15 giugno 2002, di conversione del Decreto Legge 15 aprile n. 63, ha introdotto il meccanismo per il progressivo allineamento della durata della copertura brevettuale: l’articolo 3, comma 8, ne ha previsto una riduzione pari a sei mesi per ogni anno solare a partire dal 2004, facendo in questo modo allontanare nel tempo i termini di scadenza dei brevetti farmaceutici: “Al fine di adeguare progressivamente la durata della copertura brevettuale complementare a quella prevista dalla normativa comunitaria le disposizioni di cui alla legge 19 ottobre 1991, n. 349, ed al regolamento (CEE) n. 1768/1992 del Consiglio, del 18 giugno 1992, trovano attuazione attraverso una riduzione della "protezione complementare" pari a sei mesi per ogni anno solare, a decorrere dal 1 gennaio 2004, fino al completo allineamento alla normativa europea. Le aziende che intendono produrre specialità farmaceutiche al di fuori della copertura brevettuale possono avviare la procedura di registrazione del prodotto contenente il principio attivo in anticipo di un anno rispetto alla scadenza della copertura brevettuale complementare del principio attivo”.
Questa disposizione è stata confermata e ripresa integralmente dall’art.61 comma 4 del Codice di Proprietà Industriale, introdotto dal D.Lgs. 10 febbraio 2005 n. 30.
L'Art. 68 del citato Decreto Legislativo ha però introdotto delle limitazioni alla facoltà esclusiva attribuita dal diritto di brevetto, raffigurandosi come punto di fondamentale importanza per l'avvio dell'attività produttiva in Italia di medicinali generici. La norma ha stabilito infatti che: “La facoltà esclusiva attribuita dal diritto di brevetto non si estende, quale che sia l'oggetto dell'invenzione: a) agli atti compiuti in ambito privato ed a fini non commerciali, ovvero in via sperimentale ancorché diretti all'ottenimento, anche in paesi esteri, di un'autorizzazione all'immissione in commercio di un farmaco ed ai conseguenti adempimenti pratici ivi compresi la preparazione e l'utilizzazione delle materie prime farmacologicamente attive a ciò strettamente necessarie”.






