Criticità legate ai costi di produzione e sviluppo e a vincoli burocratici limiteranno la disponibilità di farmaci biosimilari in Europa nei prossimi anni, portando al rischio di mancati risparmi per almeno 15 miliardi di euro
La concorrenza dei biosimilari in Europa ha svolto un ruolo fondamentale nel raggiungimento di significativi risparmi sanitari e nell’ampliamento dell’accesso dei pazienti ai farmaci chiave ma c’è il rischio che tali vantaggi possano non riproporsi in futuro. A lanciare l’allarme su un possibile “vuoto biosimilare” è IQVIA che - in un rapporto appena pubblicato (The Biosimilar Void)- prende in esame il gruppo di farmaci biologici che perderanno la protezione brevettuale nei prossimi 10 anni, tenendo presente la tempistica media di sviluppo per i nuovi candidati biosimilari (~7-10 anni).
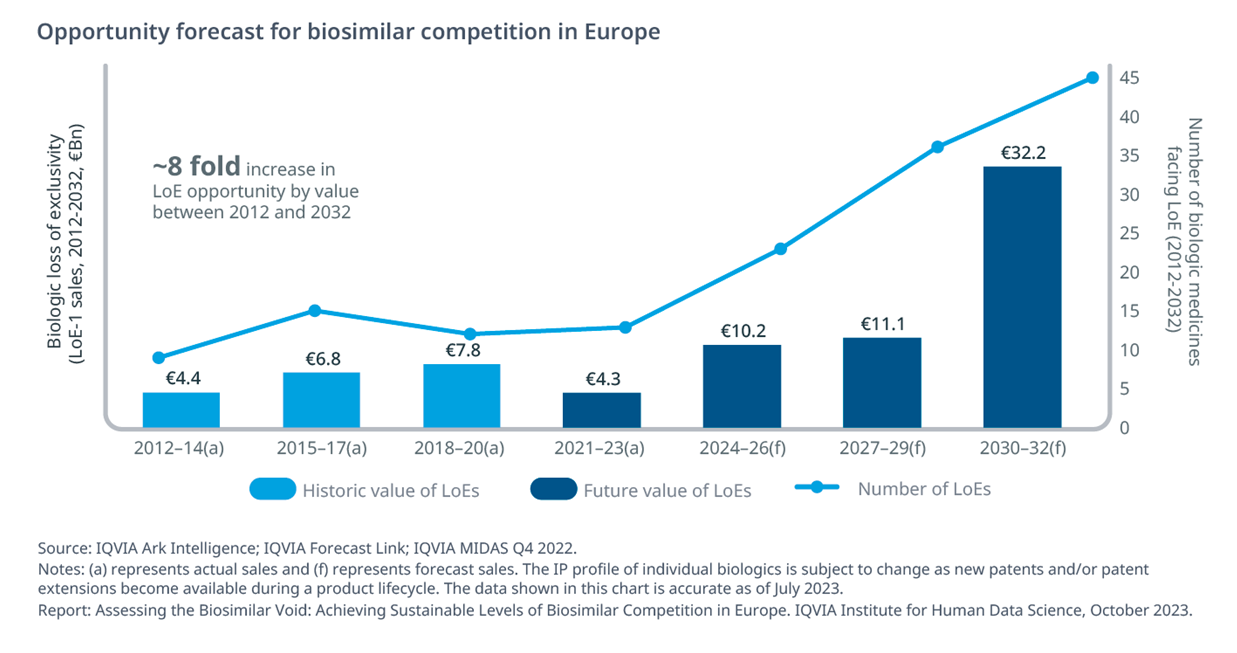
Dai dati analizzati emerge che entro la fine del 2032 perderanno esclusività 110 biologici per un valore di mercato complessivo di circa 30 miliardi di euro: un valore otto volte superiore rispetto al periodo 2012-2014 dovuto al valore e alla natura dei prodotti in scadenza - pembrolizumab (Keytruda), daratumumab (Darzalex) e nivolumab (Opdivo), per fare qualche esempio – che creeranno opportunità senza precedenti per i pagatori, le aziende dei biosimilari e i pazienti. Tuttavia le criticità legate ai costi di sviluppo e ai vincoli burocratici potrebbero determinare mancati risparmi per circa 15 milioni di euro, circa il 25%delle opportunità totali rese disponibili da scadenze brevettuali certe.
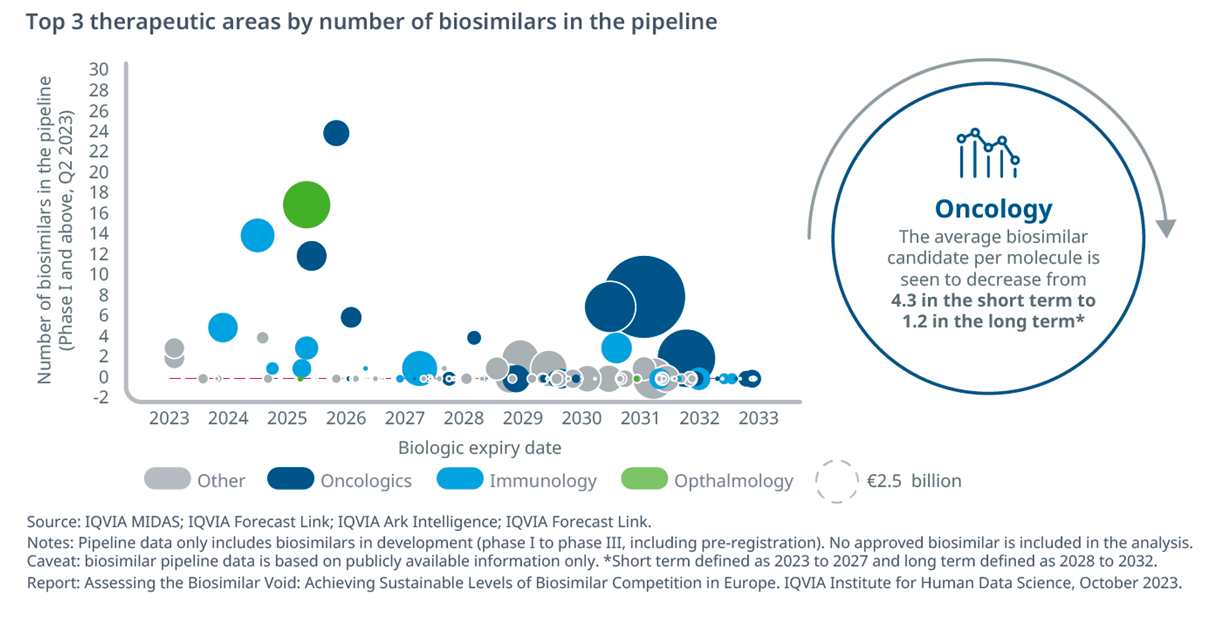
«Nei prossimi 10 anni - sottolinea IQVIA - la gran parte dei biologici in scadenza apparterrà alle aree per il trattamento delle patologie oncologiche (24%), del sistema immunitario (11%) e dei disturbi del sangue (10%). In particolare nel breve termine – ovvero nei prossimi cinque anni, dunque entro il 2027 - l’oncologia assorbirà la quota maggiore di programmi di sviluppo di biosimilari (44%), mentre nel lungo termine il numero medio di biosimilari in sviluppo diminuirà da 2,19 per molecola a 0,43 principalmente proprio a causa della forte diminuzione del numero medio di candidati onco-biosimilari (da 4,3 a 1,2)».
Alla base del fenomeno - secondo IQVIA – i costi e i tempi necessari per immettere sul mercato un medicinale biosimilare, che limitano sempre più la capacità degli sponsor di sviluppare e lanciare nuovi prodotti, aumentando il tempo necessario per la produzione e l’approvazione dei farmaci biosimilari nel lungo termine.
Dei 26 prodotti a maggior mercato destinati alla perdita del brevetto nei prossimi 10 anni, quasi uno su tre (27%) non ha ancora un candidato biosimilare in cantiere, per un totale di circa 8 miliardi di euro di opportunità mancate per i pagatori.
I dati sono ancora più critici se riferiti alla categoria dei prodotti a “bassa vendita”, ovvero quelli che si prevede raggiungeranno meno di 500 milioni di euro di vendite annuali in Europa al momento della scadenza, condizione che in numeri assoluti riguarda il 76% (84) dei prodotti biologici con brevetto in scadenza entro i 2023: la previsione è che solo il 7% di essi sarà oggetto di concorrenza nei prossimi 10 anni, con un valore di mancata opportunità di minore spesa per i servizi sanitari pari a circa 7 miliardi di euro
Stessa previsione per l’evoluzione del mercato dei farmaci orfani: entro la fine del 2032 la quota di farmaci biologici orfani che perderanno l’esclusività raggiungerà il 34%, ma i biosimilari orfani in fase di sviluppo sono pochissimi: solo un farmaco biologico orfano (eculizumab) ha finora attratto lo sviluppo di biosimilari, meno del 3% dell’intera coorte.
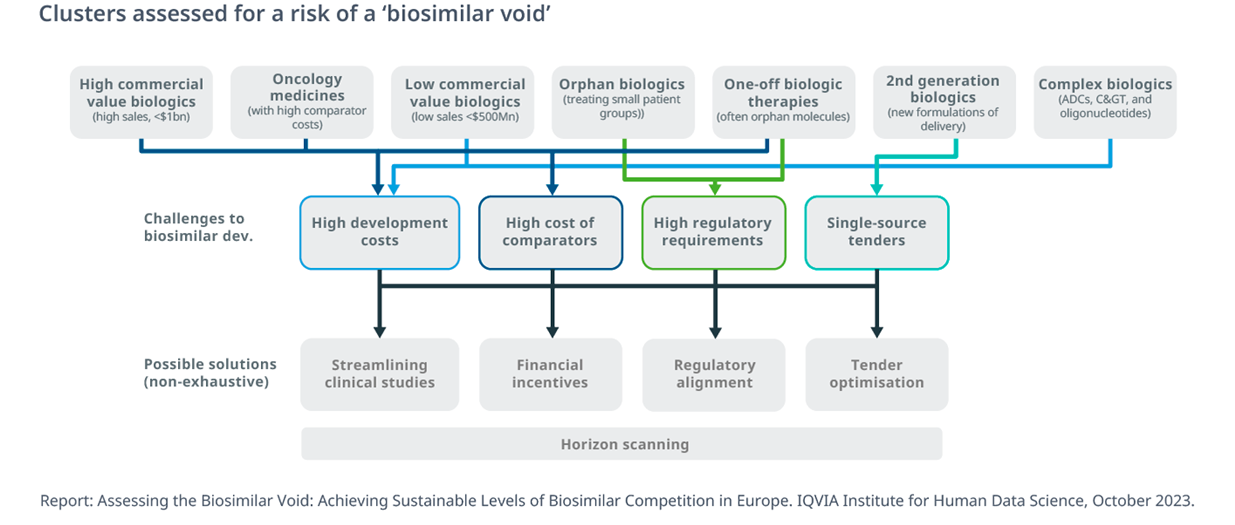
Dei 26 prodotti a maggior mercato destinati alla perdita del brevetto nei prossimi 10 anni, quasi uno su tre (27%) non ha ancora un candidato biosimilare in cantiere, per un totale di circa 8 miliardi di euro di opportunità mancate per i pagatori.
«Con un minor numero di operatori sul mercato, la concorrenza tra gli originators e i farmaci biosimilari potrebbe assomigliare alla concorrenza tra i farmaci di marca, con meno prodotti in circolazione e minori sconti sui prezzi», conclude lo studio, sottolineando la necessità di una valutazione dettagliata dei cluster di prodotti biologici a rischio di concorrenza limitata o assente si a livello europeo che mondiale.
______________
Foto: Steve Art su Pixabay







